氧化铝含量的测定原理是用硝酸将试样解聚,在PH=3时加入过量的EDTA溶液,使其与铝及其他金属离子络合,然后用氯化锌标准滴定液返滴定。
按国标GB15892-2003规定,称取约2.5g固体试样,用不含二氧化碳的水溶解,移入250ml容量瓶中,稀释至刻度,摇匀。若稀释液浑浊,用中速滤纸干过滤,此为试液A。用移液管移取10.00ml稀释液或干过滤液,置于250ml锥形瓶中,加10ml硝酸溶液,煮沸1min冷却至室温后加20.00mlEDTA溶液,加百里酚蓝溶液3-4滴,用氨水溶液中和至试液从红色到黄色,煮沸2min,冷却后加入10ml乙酸-乙酸钠缓冲溶液和2-4滴二甲酚橙指示溶液,用氯化锌标准滴定溶液滴定至溶液由淡黄色变为微红色即为终点,同时做空白试验。
以质量分数表示氧化铝(Al2O3)含量w1(%)按下式计算:
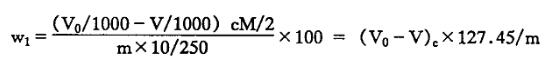
V0-空白试验消耗的氯化锌标准滴定溶液的体积,ml;
V-测定试样消耗的氯化锌标准滴定溶液的体积,ml;
c-氯化锌标准滴定溶液的实际浓度,mol/L;
m-试料的质量,g;
M-氧化铝的摩尔质量的数值,单位为克每摩尔(g/mol)(M=101.96)。
理论分析
用移液管移取10.00ml稀释液或干过滤液于250ml锥形瓶中,此时溶液的PH在3.0-4.5,加入10ml 1:12的稀硝酸后,溶液的PH在0.1-0.5,此时把溶液加热煮沸1min,则产品中带入的铝酸矿粉又与酸进行反应,矿粉中的铝被溶出,煮沸时间越长,则溶出的铝越多,导致分析结果偏高。据文献报导,氢离子与PAC中的氢氧根离子结合生成水的吉布氏自由能变化为-71kJ/mol,同时又是在溶液中进行,反应速度应该不会太慢。但实验中也发现常温下铝酸钙矿粉在PH=0.1-0.5的水溶液中0.5h,并未发生铝的溶出反应。所以从理论上讲,酸化时不加热测定的结果更符合实际。

