聚合氯化铝的盐基度,即是样品中OH-和Al3+的摩尔比的三分之一。要分析盐基度,除了准确测出Al3+的含量,还要分析OH-的含量。盐基度的分析原理是在试样中加入定量盐酸溶液,以氟化钾掩蔽铝离子,以氢氧化钠标准滴定溶液滴定。
按国标GB15892-2003规定,移取25.00ml试液A(铝分析的使用液),置于250ml磨口瓶中,加入20.00ml盐酸标准溶液,接上磨口玻璃冷凝管,煮沸回流2min,冷却至室温,转移至聚乙烯杯中,加入20ml氟化钾溶液,摇匀。加入5滴酚酞指示剂,立即用氢氧化钠标准滴定溶液滴定至溶液呈现微红色即为终点。同时用不含二氧化碳的蒸馏水做空白实验。
以百分比表示的盐基度(B%)按下式计算:
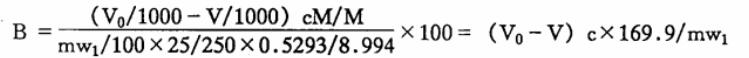
V0-空白试验消耗的氢氧化钠标准滴定溶液体积,ml;
V-测定试样消耗氢氧化钠标准滴定溶液体积,ml;
c-氢氧化钠标准滴定溶液的实际浓度,mol/L;
w1-测得的氧化铝的质量分数,%
M-氢氧根[OH-]的摩尔质量的数值,单位为克每摩尔(g/mol)(M=16.99);
0.5293-Al2O3折算成Al的系数;
8.994-[1/3 Al]的摩尔质量。
理论分析:
25.00ml试样A,加入20.00ml浓度为0.5mol/L的盐酸溶液后,混合液的酸度较大,再在沸水浴上加热回流2min,冷却至室温。如果试样中有铝酸钙矿粉存在,则会发生下述反应:
Ca(AlO2)2+8HCl=CaCl2+2AlCl3+4H2O
上述反应导致消耗的盐酸的量较多,而用氢氧化钠滴定剩余时,消耗的量就少,从而导致结果偏高,甚至超过100%(有时高于110%),试样水不溶物含量越高,即试样稀释液越浑浊,分析得到的盐基度越高,这样的分析结果肯定是不符合实际的。而在常温下铝酸钙矿粉在0.2-0.3mol/L的盐酸介质中反应很慢。如果不加热测定,结果会比较准确地反映产品的真实盐基度。

